Optische Kohärenztomographie
Autoren: Rebecca Charboneau
Die optische Kohärenztomographie (OCT) ist eine nichtinvasive, hochauflösende optische Bildgebungstechnologie, die Querschnittsbilder aus Interferenzsignalen erzeugt, die von einem zu untersuchenden Objekt und einer lokalen Referenz empfangen werden. Die OCT wird in der Medizin häufig für die Diagnose von Krankheiten und die Überwachung von Behandlungen eingesetzt, um Echtzeitbilder von bestimmten Organen zur direkten Visualisierung von Gewebestrukturen zu erhalten. Zur Optimierung der Bildauflösung wird eine breitbandige Lichtquelle verwendet. Die breitbandige Lichtquelle ermöglicht unterschiedliche Eindringtiefen in Abhängigkeit von der Wellenlänge. Dadurch können OCT-Systeme axiale Auflösungen im Bereich von 5-10 µm erreichen, was eine „optische Biopsie“ von biologischem Gewebe in vivo ermöglicht (Abbildung 1).1 Im Vergleich zur konfokalen Mikroskopie kann die OCT Bilder mit einer 100-mal besseren axialen Auflösung aufnehmen und bietet außerdem eine markierungsfreie Methode für die In-vivo-Diagnose.2 Zwar können verschiedene Lichtquellen verwendet werden, aber die Verwendung einer Breitband-Lichtquelle für OCT bietet eine kostengünstigere Option für die Systementwicklung sowie ein sicheres Energieniveau für die Verwendung mit biologischem Gewebe.
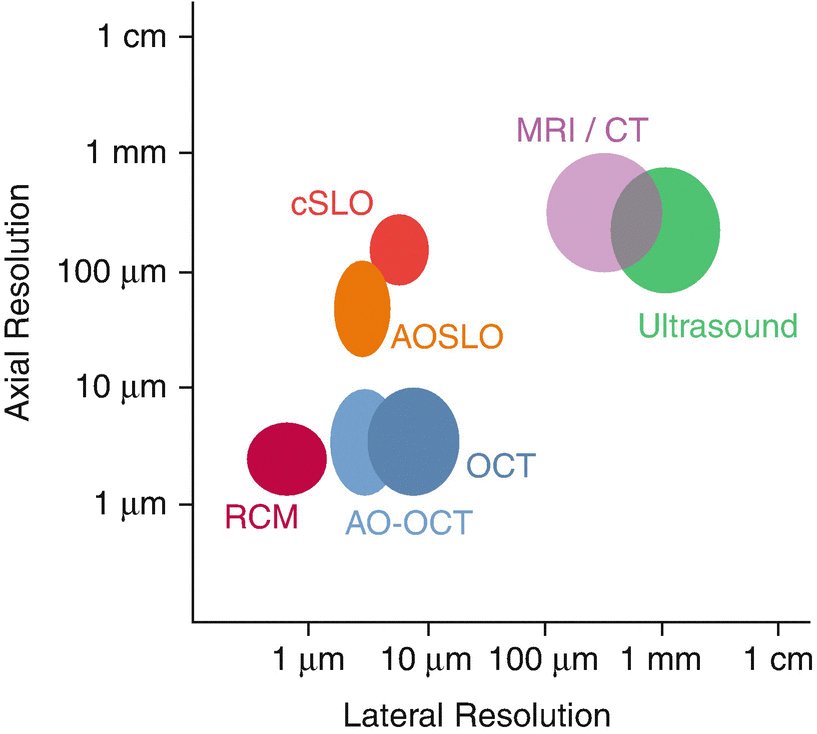
Abbildung 1: Vergleich der optischen Bildauflösung1
Und so funktioniert es
Der Grundgedanke der OCT besteht darin, Lichtwellen auf die zu untersuchende Probe zu lenken, wobei das Licht von den Materialstrukturen reflektiert wird. Als Basis eines jeden OCT-Systems wird ein Interferometer vom Michelson-Typ verwendet (Abbildung 2). Die Grundlagen dieses Systems beruhen darauf, dass das Licht einer breitbandigen Lichtquelle durch einen Strahlteiler in zwei Pfade aufgeteilt wird. Wenn das Licht durch den Strahlteiler geleitet wird, wird ein Strahl auf die Probe und der andere auf einen beweglichen Referenzspiegel gerichtet. Das Licht aus dem Referenzarm legt eine bestimmte optische Distanz zurück und bildet nur mit dem Licht, das die gleiche optische Distanz im Probenarm zurücklegt, ein entsprechendes Interferenzmuster. Wenn das Licht aus beiden Armen zum Strahlteiler zurückkehrt, wird ein Interferenzmuster erzeugt, das dann von einem Detektor analysiert wird und ein Signal ausgibt. Dieses Interferenzmuster kann zweidimensionale (2D) und dreidimensionale (3D) Bilder von Geweben im Körper (in vivo) erzeugen. Die Kombination aus adaptiver Optik und OCT (AO-OCT), wie in Abbildung 1 dargestellt, kann die begrenzte Leistung durch den Einsatz von Technologien zur Korrektur der optischen Wellenfront überwinden.3 Beispielsweise wird in einem AO-OCT-System ein deformierbarer Spiegel anstelle eines optischen Standardspiegels verwendet, um vorhandene Aberrationen zu reduzieren und eine höhere axiale Auflösung in der Größenordnung von 2-5 µm zu erzielen.3
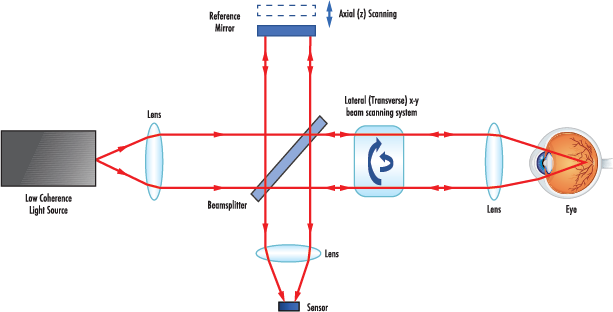
Abbildung 2: Optisches Diagramm der OCT
Beschreibung des optisches Pfads
- Lichtquelle: Nach dem klassischen Prinzip der OCT wird eine breitbandige Lichtquelle mit kurzer Kohärenzlänge zur Bildgebung verwendet. Die kürzere kohärente Länge des emittierten Lichts verbessert die axiale Auflösung bei der OCT-Bildgebung. Mit alternativen Quellen, z. B. einem Swept-Wavelength-Laser, lässt sich der frequenzabhängige Reflexionsgrad einer bestimmten Probe jedoch optimieren, um eine bessere Auflösung zu erzielen. Je nach Probe können auch bestimmte Wellenlängen, wie sichtbares oder infrarotes Licht, verwendet werden, um die Lichtstreuung zu verringern. Durch die Auswahl der richtigen Lichtquelle für die jeweilige Probe kann die Leistung des OCT-Systems optimiert werden.
- Strahlteiler: Platten- oder Würfel-Strahlteiler können in der OCT eingesetzt werden, um das Licht in zwei verschiedene Pfade aufzuteilen: den Referenzstrahl und den Probenstrahl. Dank eines Reflexionsverhältnisses von 50/50 lässt sich der Referenzstrahl auf den beweglichen Referenzspiegel reflektieren, während der Probenstrahl mit Hilfe einer optischen Linse auf die Probe fokussiert wird. Es gibt spezielle Beschichtungen, die eine bestimmte Wellenlänge einer breitbandigen Lichtquelle durchlassen.
- Dielektrische optische Spiegel: Mit diesem Spiegel wird der Referenzstrahl auf eine bekannte Weglänge zurück in das Interferenzsystem reflektiert. Der montierte Referenzspiegel in einem OCT-System hat eine kontrollierte Verschiebung, um das axiale Scannen der Probe zu ermöglichen. Diese Spiegel verfügen über eine dielektrische Beschichtung, die sich ideal für Reflexionsanwendungen eignet, da die Spiegel zu mehr als 99% reflektieren.
- Optische Linse: Mit einer plankonvexen (PCX) Standard-Linse) lassen sich die geteilten Strahlengänge auf die Probe und den Detektor fokussieren. Mögliche sphärische und chromatische Aberrationen können mit einer asphärischen oder achromatischen Linse reduziert werden. Diese Linsen fokussieren das Licht in der Probe auf eine kleinere Punktgröße mit geringeren Abbildungsfehlern, wodurch das OCT-System präziser wird.
- Detektor: Der Detektor kann in Form eines CCD- oder eines CMOS-Sensors vorliegen, der in der Lage ist, die von der Probe und dem Referenzstrahl emittierten Frequenzen aufzulösen. Jede Frequenz entspricht einer bestimmten Tiefe innerhalb der Probe, die dann in A-Scans umgewandelt wird, um schließlich als Bild ausgegeben zu werden.
- Verformbarer Spiegel: speziell für AO-OCT-Anwendungen. Ein verformbarer Spiegel ist eine adaptive Optik, die zur Reduzierung von Abbildungsfehlern und zur Verbesserung der Bildqualität für eine bessere Auflösung eingesetzt wird. Die Form des Spiegels wird durch ein externes Signal gesteuert, um die Wellenfront für eine verbesserte Systemleistung zu korrigieren.
Zustandekommen und Aussehen des Bildes
Das vom Detektor aufgezeichnete Ausgangssignal ist ein Tiefenscan oder wird allgemein als A-Scan oder 1D-Scan bezeichnet (Abbildung 3). Der A-Scan beschreibt die axiale Auflösung des Systems und wird durch die Bandbreite oder Kohärenzlänge der Lichtquelle definiert. Mit abnehmender Bandbreite der Lichtquelle nimmt die axiale Auflösung zu, was das Auflösungsvermögen des Systems erhöht. Nachdem ein A-Scan aufgenommen wurde, bewegt sich der Lichtstrahl seitlich über die Probe, um B-Scans vorzunehmen. Der B-Scan liefert strukturelle Querschnittsinformationen, mit denen 2D-Bilder auf der Grundlage von Größe, Phase, Frequenzverschiebung und Polarisation des Interferenzlichtsignals aufgelöst werden können.4 3D- oder volumetrische Bilder werden durch die Erfassung mehrerer A-Scans pro B-Scan und mehrerer B-Scans pro 3D-Volumen erstellt.4 Die in axialer und lateraler Richtung erfassten Intensitätsinformationen ermöglichen die Erstellung von 3D-Bildern.
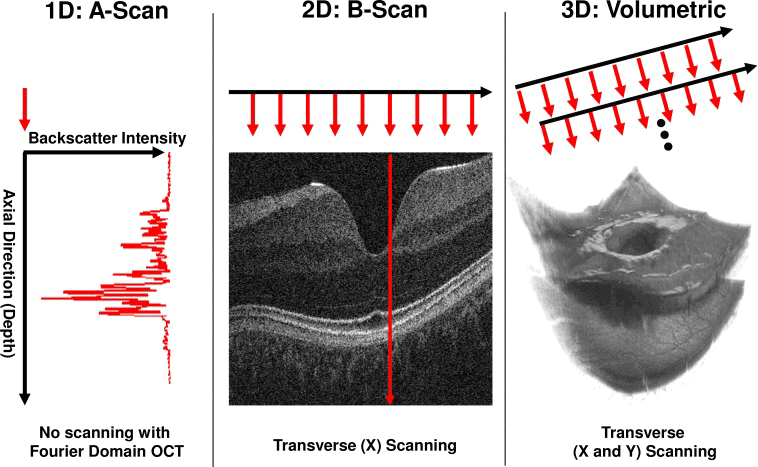
Abbildung 3: OCT-Bildakquisition 5
Mit dem von einem OCT-System erzeugten Bild können mehrschichtige Strukturen in einer Probe, z. B. die Schichten des Auges, sichtbar gemacht werden (Abbildung 4). Die folgende Abbildung zeigt zum Beispiel ein OCT-Bild der Netzhaut auf der rechten Seite im Vergleich zu einem digitalen 2D-Netzhautbild auf der linken Seite. Auf dem OCT-Bild lassen sich Unterschiede in der Dichte des Netzhautgewebes besser erkennen, da sich die Farbintensität ändert, wenn z. B. Narbengewebe sichtbar wird. Die im Bild erzeugte Farbskala ist das Ergebnis des unterschiedlichen Reflexionsvermögens der inneren Strukturen der Probe.
Abbildung 4: OCT-Netzhautbilder
Anwendungen der OCT
Anwendung 1: Ophthalmologie
Dank OCT können Ärzte Augenkrankheiten wie die altersbedingte Makuladegeneration (AMD), die zu verschwommenem Sehen führt, besser diagnostizieren (Abbildung 5). Zwei Ursachen der AMD sind eine Verschlechterung der Netzhaut durch Ausdünnung des Gewebes (trockene AMD) oder die Bildung undichter Blutgefäße unter der Netzhaut (feuchte AMD).6 Mit der OCT-Technologie können Ärzte Veränderungen in der Morphologie des Netzhautgewebes quantitativ charakterisieren, im Gegensatz zu älteren Verfahren, die nur qualitative Daten liefern.6 Die OCT kann beispielsweise Bilder der Netzhaut mit einer Auflösung von 5-7 µm liefern, um Biomarker wie die Bildung undichter Blutgefäße zu verfolgen.6 Auch die Wirksamkeit von Therapien kann mit der OCT verfolgt werden: anhand der Quantifizierung von Netzhautdicke und Biomarkern lässt sich festzustellen, ob die Krankheit fortschreitet.
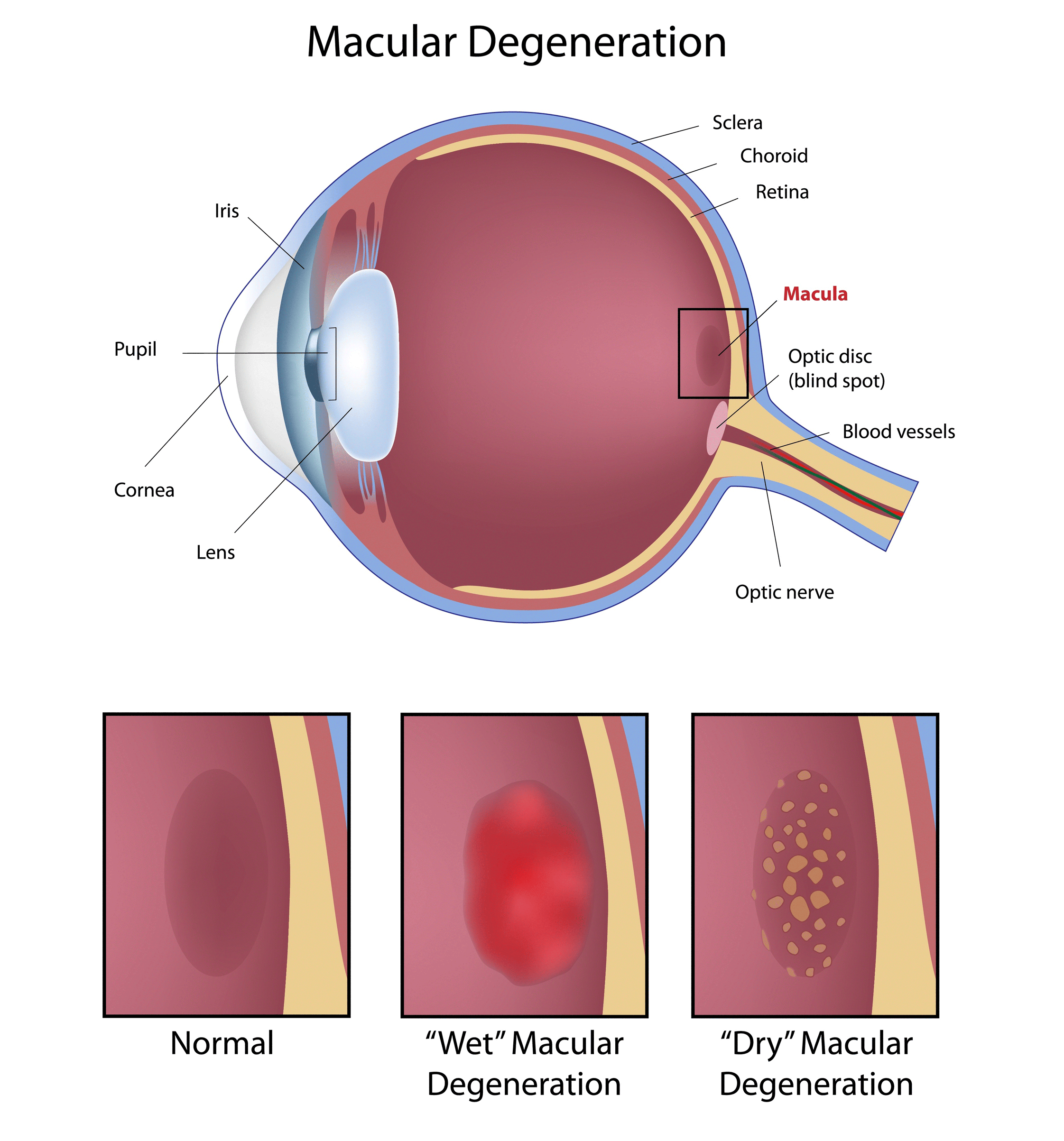
Abbildung 5: Altersbedingte Makuladegeneration
Anwendung 2: Kardiologie
Ein weiterer Bereich, in dem die OCT eingesetzt wird, ist die Kardiologie mit dem Ziel, die Wahrscheinlichkeit eines Herzinfarkts zu diagnostizieren. Eine der Hauptursachen für Herzinfarkte ist die Arteriosklerose, bei der sich eingerissene Fettablagerungen (Plaques) und Kalzium in der Arterienwand einlagern und den Blutfluss blockieren.7 Ärzte nutzen vermehrt die OCT-Technologie, um gefährdete Plaques vor der Ruptur zu erkennen. Mit der OCT können Ärzte Plaques in der Arterienwand mit einer Bildauflösung von 5-7 µm sichtbar machen, um die Größe, Form und Lage der Plaques zu bestimmen.8 Die hohe Empfindlichkeit der OCT ermöglicht eine bessere axiale Penetration zur Darstellung von Plaques vor der Ruptur im Vergleich zu anderen Diagnosemethoden wie Angiographie und intravaskulärem Ultraschall, so dass eine frühzeitige Diagnose möglich ist.
Optische Kohärenztomographie bei Edmund Optics®
Edmund Optics® liefert eine breite Palette von Optiken, die sich ideal für OCT-Systeme eignen. Mit den Fortschritten der OCT-Technologie wird Edmund Optics® seine Produktauswahl und seinen technischen Support weiter ausbauen. Zu den bemerkenswerten Trends, auf die sich die OCT-Technologie zubewegt, gehören die Tragbarkeit von Systemen, die Zugänglichkeit und die Miniaturisierung. Multimodales OCT, das ergänzende Techniken wie Mikroskopie oder Endoskopie mit OCT verbindet, AO-OCT und miniaturisierte OCT-Chip-basierte Systeme gehören zu den am weitesten fortgeschrittenen OCT-Anwendungen der Zukunft, auf die man achten sollte.7 Diese modernen OCT-Technologien werden auch weiterhin Innovationen in den Bereichen Biomedizin, Materialbearbeitung und anderen industriellen Anwendungen vorantreiben, die Edmund Optics® weiterhin unterstützen wird.

 Strahlteilerplatte für VIS und NIR
Strahlteilerplatte für VIS und NIR
- Reflexionsvermögen ≤1% bei 400-700 nm oder 700-1100 nm zur Reduzierung von Rückreflexionen
- Breitbandige dielektrische Beschichtungen haben im Vergleich zu metallischen Beschichtungen einen minimalen Energieverlust
- Reflexions-/Transmissionsverhältnis 50/50
- Ideal für Laserstrahlen mit geringer Leistung
JETZT KAUFEN

 Standardmäßige Strahlteilerwürfel
Standardmäßige Strahlteilerwürfel
- Mehrlagige dielektrische Beschichtung für geringere Reflexion
- Reflexions-/Transmissionsverhältnis 50/50
- Ideal für Laserstrahlen mit geringer Leistung
- Minimaler Absorptionsverlust
JETZT KAUFEN

 Breitbandige dielektrisch beschichtete λ/10 Oberflächenspiegel
Breitbandige dielektrisch beschichtete λ/10 Oberflächenspiegel
- Reflektivität >99% in einem breiten Wellenlängenbereich
- Minimaler Energieverlust, ideal für die Strahllenkung
- Hochwertige Quarzglassubstrate
JETZT KAUFEN

 Plankonvexe Linsen (PCX)
Plankonvexe Linsen (PCX)
- AR-Beschichtungsoptionen für einen Reflexionsgrad von <0,5% über einen bestimmten Wellenlängenbereich verfügbar
- Entwickelt für einen Einfallswinkel von 0°
- Ideal zum Kollimieren und Fokussieren von Licht
JETZT KAUFEN
Lumedica OCT-Bildverarbeitungssystem
- Günstiges Bildgebungssystem für die optische Kohärenztomographie
- Ideal für die Abbildung biologischer Proben, Probencharakterisierung und OCT-Ausbildung
- Kompaktes Design für den Labortisch
JETZT KAUFEN
Literatur
- Silke Aumann, Sabine Donner, Jörg Fischer, & Frank Müller. (2019, August 14). Optical Coherence Tomography (OCT): Principle and Technical Realization. High Resolution Imaging Microscopy and Ophthalmology, 59-85.
- Dan P. Popescu, et al. (2011, September). Optical Coherence Tomography: Fundamental Principles, Instrumental Designs and Biomedical Applications. Biophysical Reviews, 3(3): 155.
- Michael Pircher and Robert J Zawadzki. (2017, May 1). Review of adaptive optics OCT (AO-OCT): principles and applications for retinal imaging. Biomedical Optics Express, 8(5): 2536-2562.
- Michelle Gabriele, et al. (2010, June 11). Three Dimensional Optical Coherence Tomography Imaging: Advantages and Advances. Progress in Retinal Eye Research, 29(6): 556-579.
- Martin Kraus, Markus Mayer. (2012, June). Motion correction in optical coherence tomography volumes on a per A-scan basis using orthogonal scan patterns. Biomedical Optics Express, 3(6): 1182-1189.
- Alfredo Garcia-Layana, Gianfranco Cuiffo, Javier Zarranz-Ventura, Aurora Alvarez-Vidal. (2017, July). Optical Coherence Tomography in Age-Related Macular Degeneration. AMD Book.
- Mitsuyasu Terahima, Hideaki Kaneda, & Takahiko Suzuki. (2012, February 28). The Role of Optical Coherence Tomography in Coronary Intervention. Korean Journal of Internal Medicine, 27(1): 1-12.
- Renae Keep. (2021, October 20). Bright prospects for OCT at 30. SPIE Publications.
Weitere Informationen
- Strahlteiler – Grundlagen und Anwendungen
- Alles über Beugungsgitter
- Spiegel mit hoher Reflexion
- Hintergrundinformationen zu optischen Spezifikationen
- Spiegel mit hoher Reflexion für Laseranwendungen
- Teaching Principles & Applications of OCT
- Fundamentals of Lasers
- Wesentliche Parameter eines Lasersystems
- Introduction to Adaptive Optics and Deformable Mirrors













weitere regionale Telefonnummern
ANGEBOTSTOOL
Geben Sie zum Starten die Produktnummer ein.
Copyright 2023 | Edmund Optics, Ltd Unit 1, Opus Avenue, Nether Poppleton, York, YO26 6BL, UK
Die Edmund Optics GmbH Deutschland fungiert als Handelsvermittler für die Edmund Optics Ltd. in Großbritannien.
Vertragspartner ist die Edmund Optics Ltd. in Großbritannien.