Lichtscheibenmikroskopie
Autoren: Maura Francis, Cory Boone, Jaclyn Wycoff
Die Lichtscheiben-Fluoreszenzmikroskopie (Light Sheet Fluorescence Microscopy, LSFM), auch bekannt als Lichtblattmikroskopie oder als Selective Plane Illumination Microscopy (SPIM), ist ein Fluoreszenzmikroskopieverfahren mit mittlerer bis hoher Auflösung, das Bilder mit hoher Geschwindigkeit aufnimmt. Es eignet sich hervorragend für die Abbildung dreidimensionaler biologischer Proben in verschiedenen Tiefen, das Erstellen optischer Schnitte. Eine Laserlichtscheibe wird in eine zweidimensionale Ebene fokussiert, in der Regel mit einer Zylinderlinse, um nur einen dünnen Abschnitt der Probe zu beleuchten und die Fluoreszenz anzuregen. Dadurch wird die Phototoxizität verringert und die Probe weniger geschädigt (Abbildung 1).

Abbildung 1: Bei der Lichtscheiben-Fluoreszenzmikroskopie (LSFM) wird Fluoreszenz in dreidimensionalen Proben über eine zweidimensionale Ebene angeregt, die ein kleineres Volumen abdeckt als die Anregung bei herkömmlichen Fluoreszenztechniken. Dies verringert die Phototoxizität und die Schädigung empfindlicher biologischer Proben.1
Bei der herkömmlichen Epifluoreszenzmikroskopie wird ein viel größerer Bereich der Probe beleuchtet. Die Anregungsbeleuchtung geht in axialer (z) Richtung durch die Probe und regt Fluoreszenz sowohl in der Fokusebene als auch außerhalb davon an.1 Diese unscharfe Fluoreszenz erschwert die genaue Messung des fokussierten Signals.
Und so funktioniert es
Bei Epifluoreszenz- oder konfokalen Mikroskopen teilen sich die Beleuchtung zur Anregung und das Abbildungsobjektiv einen gemeinsamen Lichtweg. Bei der LSFM ist die Beleuchtungsquelle getrennt und steht in der Regel senkrecht zum Detektionspfad im System.2 Die verschiedenen LSFM-Konfigurationen können im Allgemeinen in Systeme mit planaren oder gescannten Lichtscheiben unterteilt werden.1 In diesem Leitfaden wird in erster Linie die Konfiguration mit planarer Lichtscheibe behandelt, bei der eine planare Laserlichtscheibe durch die Kombination einer Zylinderlinse mit einem Gaußstrahlerzeugt wird.2 Durch Abflachung des durch das System laufenden Strahls, der ansonsten kreisförmig ist, erzeugt die Zylinderlinse einen Lichtstreifen parallel zur Fokusebene.2 Da eine ganze Ebene erfasst wird, verkürzt sich die Abbildungszeit erheblich im Vergleich zu herkömmlichen Techniken, bei denen nur ein Lichtpunkt fokussiert wird. Dies ist ein großer Nachteil der Multiphotonenmikroskopie, bei der die Proben unter Umständen stundenlang abgebildet werden müssen, während dies bei der LSFM nur Minuten dauert.2 Die Handhabung und Verarbeitung der Daten wird jedoch bei der Menge der erfassten Daten schnell zu einem Problem.1 Die LSFM kann mit Multiphotonenmikroskopie eingesetzt werden, um die Abbildungstiefe in der Probe und die räumliche Auflösung zu verbessern.3 Ein weiterer Nachteil der LSFM ist die Komplexität der Ausrichtung bei der Verwendung von mehr als zwei Objektiven.
Die LSFM wird hauptsächlich zur Abbildung biologischer Proben verwendet und kann in vivo durchgeführt werden. Relativ große (mehrere mm große), optisch transparente Proben können mit dieser Technik aufgrund der Lichtdurchlässigkeit des Laserstrahls abgebildet werden. Während andere Techniken für Bilder mit höherer Auflösung attraktiver sein mögen, bietet die LSFM den Vorteil, dass die Probe nur wenig durch Licht beschädigt wird. Bei Zellanwendungen, bei denen Bewegung und dynamische Prozesse eine Rolle spielen, bietet die LSFM die Möglichkeit, große Bereiche schnell abzubilden.3 Mit dieser Technik lassen sich dreidimensionale Volumina im Zeitraffer über lange Zeiträume hinweg beobachten.4 Um erfolgreiche Zeitrafferergebnisse zu erhalten, muss die optische Stabilität aufrechterhalten werden. Temperaturschwankungen können zu Verschiebungen in der Probe führen, und Zeitraffer eignen sich nicht gut für die Abbildung lebender Proben, da sich diese während der Aufnahme des Zeitraffers bewegen können.
Die Hauptvorteile der Lichtscheibenmikroskopie lassen sich alle auf die planare Beleuchtung zurückführen. Bei herkömmlichen Mikroskopietechniken ist es schwierig, die Intensität des Lichts durch dicke Proben hindurch zu erhalten. Bei der Abbildung dicker Proben ist es normal, dass die Lichtintensität über die Länge der Fokusebene abnimmt. Dies kann bei Proben mit undurchsichtigen Strukturen, die das Licht blockieren können, noch offensichtlicher werden. In diesem Fall tritt ein Streifeneffekt auf, der die Struktur wie einen Schatten aussehen lässt, und es kommt zu einem Verlust an Auflösungs1 Die LSFM und die Implementierung von zwei Beleuchtungsquellen auf beiden Seiten der Probe helfen, den Lichtabfall zu kompensieren.2
Aussehen des Bildes
Abbildung 2 zeigt, wie der Unterschied zwischen den Beleuchtungsmethoden der konventionellen Fluoroszenzmikroskopie und der LSFM das Erscheinungsbild der Aufnahme verändern kann.
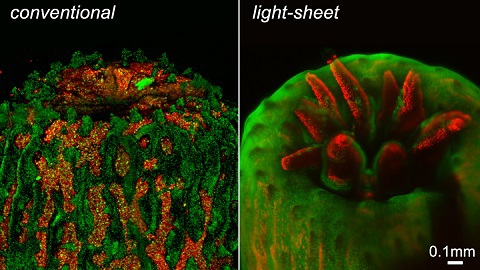
Abbildung 2: Ein Polyp, der mit einem herkömmlichen Fluoreszenzmikroskop abgebildet wird, weist ein erhebliches Hintergrundrauschen durch Fluoreszenz außerhalb der Fokusebene auf. Die intensive Beleuchtung bewirkt außerdem, dass sich der Polyp zurückzieht. Bei der LSFM hingegen wird diese unscharfe Fluoreszenz eliminiert, und der Polyp tritt unter der sanfteren Beleuchtung eines von der Universität Essex entwickelten LSFM-Systems vollständig hervor.1, 4
Abbildung 2: Ein Polyp, der mit einem herkömmlichen Fluoreszenzmikroskop abgebildet wird, weist ein erhebliches Hintergrundrauschen durch Fluoreszenz außerhalb der Fokusebene auf. Die intensive Beleuchtung bewirkt außerdem, dass sich der Polyp zurückzieht. Bei der LSFM hingegen wird diese unscharfe Fluoreszenz eliminiert, und der Polyp tritt unter der sanfteren Beleuchtung eines von der Universität Essex entwickelten LSFM-Systems vollständig hervor.1, 4
Bei der LSFM gibt es mehrere Komponenten, die im Hinblick auf eine Verbesserung der Bildqualität eine Rolle spielen. Die Probe wird verschoben und gedreht, um mehrere dünne Scheiben parallel zur Brennebene abzubilden, oder die Lichtscheibe selbst wird über die Probe gescannt.2 Indem derselbe Teil der Probe aus verschiedenen Blickwinkeln aufgenommen wird, kann die Auflösung durch die Zusammenführung der einzelnen Bilder erhöht werden. Auch die numerische Apertur (NA) der Beleuchtungsobjektive beeinflusst die Auflösung.2 Die NA bestimmt den Winkel, in dem das Objektiv Licht sammeln oder aussenden kann. Ein Objektiv mit einer hohen NA kann eine bessere beugungsbegrenzte Auflösung erzielen und bewirkt, dass der sichtbare Bereich der Probe, das so genannte Bildfeld (FOV), kleiner wird. Ein kleines Bildfeld ist jedoch nicht ideal für die Abbildung dicker Proben, da die Abbildung eines bestimmten Areals mehr Zeit in Anspruch nimmt. Mit der LSFM lassen sich Proben mit einer Dicke im zweistelligen Millimeterbereich abbilden, ohne dass das Bild durch den Beleuchtungsabfall beeinträchtigt wird, das sind etwa 9 mm mehr als bei einem typischen konfokalen Mikroskop.1 Dies ist wichtig für die Abbildung dicker Proben mittels Fluoreszenzmikroskopie, da Sekundärfluoreszenz außerhalb des Fokusbereichs auftritt und das Bild verdecken kann. Bei der LSFM tritt dieses Problem nicht auf, da sie nur die Ebene im Fokus beleuchtet und keine andere überschüssige Fluoreszenz angeregt wird.
Wenn die Technik eine Lichtscheibe verwendet, die durch einen Gaußstrahl mit einer dünnen Taille erzeugt wird, führt dies zu einer höheren Auflösung in axialer Richtung. Allerdings verringert sich dadurch die Ausbreitungslänge über die Beleuchtungsachse. Dadurch wird das Bildfeld kleiner. Dagegen kann ein Gaußstrahl mit einer dicken Taille verwendet werden, was zu einer größeren Ausbreitungslänge führt, aber wiederum die Auflösung verringert.4 Dies kann jedoch auch zu einer Zunahme der Lichtschäden an der Probe führen.
Technische Details
Auch wenn es zahlreiche Variationen von LSFM-Aufbauten gibt, zeigt Abbildung 3 ein typisches Systemlayout, bei dem eine Laserquelle zur Beleuchtung verwendet wird und ein Scannerspiegel den Laserstrahl über eine stationäre Probe bewegt. Mehrere Laserquellen und -detektoren können mit Hilfe von dichroitischen Filtern, auch dichroitische Spiegel genannt, zur Kombination der Strahlen eingesetzt werden.

Abbildung 3: Vereinfachtes Schema für ein LSFM-System.5
- Laseranregungsquelle: sendet einen Gaußschen Laserstrahl in das System, der auf die Probe fokussiert wird. Mehrere Laser können mit dichroitischen Filtern kombiniert und alle auf den Scannerspiegel gerichtet werden.3
- Scannerspiegel: passt die Position des Laserstrahls an und bestimmt, wo er die Probe berührt.
- Strahlaufweiter: vergrößert den Strahldurchmesser, bevor der Strahl die Zylinderlinse erreicht. Dies ermöglicht eine engere Fokussierung in der schmalen Dimension der Lichtscheibe.
- Zylinderlinse: fokussiert den Strahl in einer Dimension, so dass nach dem Durchgang des Strahls durch das Beleuchtungsobjektiv eine dünne Lichtscheibe auf der Probe gebildet wird.
- Beleuchtungsobjektiv(e): senkrecht zu dem/den Detektor(en) angeordnet. Es bestimmt das Bildfeld und die Lichtmenge, der die Probe ausgesetzt ist, abhängig von seiner NA. Gelegentlich werden zwei Beleuchtungsobjektive und Laserstrahlengänge auf beiden Seiten der Probe verwendet, um den Lichtabfall zu minimieren.
- Fixieren der Probe: entscheidend, da sie im Wesentlichen bestimmt, welches LSFM zu implementieren ist. Es gibt verschiedene Möglichkeiten, eine Probe zu fixieren: indem man sie in ein Gel einbettet, sie aufhängt, in ein Medium eintaucht oder auf ein Deckglas gibt.2
- Detektorobjektiv: sammelt das Licht, das aus dem System austritt, um es analysieren zu können. Um die Auflösung zu verbessern, werden in der Regel hohe NAs bevorzugt, und wenn die Probe in eine Flüssigkeit eingetaucht ist, werden häufig Wasserimmersionsobjektive verwendet.
- Filter: Notch-, Langpass- oder Bandpassfilter eliminieren einen Teil der Laserstrahlung, die von der Probe gestreut wird.
- Tubuslinse: erzeugt ein Bild auf dem Detektor. Bei Verwendung mehrerer Detektoren können dichroitische Filter die verschiedenen Wellenlängen nach dem Detektorobjektiv aufteilen. Jede Wellenlänge hätte dann ihren eigenen Strahlengang, Notchfilter, Tubusinse und Detektor.
- Detektor: Bilder erfassen.
- Verschiebebühne (xyzθ): ermöglicht die Bewegung in den Richtungen x-y-z mit Rotation. So können Bilder aus verschiedenen Blickwinkeln aufgenommen werden, die dann zur Erhöhung der Auflösung zusammengefügt werden.
Anwendungen der Lichtscheiben-Fluoreszenzmikroskopie
Anwendung 1: Überwachung der Embryonalentwicklung
Einer der häufigsten Anwendungsfälle der LSFM ist die Überwachung der Entwicklung von Embryonen (Embryogenese) sowohl bei Menschen als auch bei Tieren.1 Die Embryonen werden mit fluoreszierenden Farbstoffen markiert, die durch die Lichtscheibe eines LSFM-Systems angeregt werden können. So können Wissenschaftler das Zellwachstum bei der Entwicklung von Embryonen verfolgen. Mit einer implementierten Software lassen sich die Zellen automatisch verfolgen. Das große Sichtfeld und die hohe Geschwindigkeit der LSFM sind von Vorteil für die Abbildung von Embryonen und anderen großen, lebenden Proben.
Anwendung 2: Hals-Nasen-Ohren-Heilkunde (HNO), insbesondere im Bereich des Ohrs
Die LSFM hat sich auch in der HNO-Heilkunde bewährt, da sie sich gut für die Darstellung der Komponenten des Mittel- und Innenohrs eignet.1 Mittels LSFM konnten Forscher 3D-Modelle von Ohrstrukturen erstellen, die detaillierter waren als frühere Modelle.
Vergleich mit anderen Mikroskopietechniken6
| Technik | Auflösung | Probengröße | Relative Kosten | Photobleacing |
|---|---|---|---|---|
| Konfokalmikroskopie | <µm | µm | $$ | Ja |
| Multiphotonenmikroskopie | <µm | mm | $$$ | Weniger |
| Lichtscheiben-Fluoreszenzmikroskopie | µm | >cm | $ | Am wenigsten |
Lichtscheiben-Fluoreszenzmikroskopie bei Edmund Optics®
Edmund Optics® liefert eine breite Palette von Optiken für LSFM-Anwendungen, darunter Strahlaufweiter, Zylinderlinsen, Mikroskopobjektive und Notchfilter. Es werden ständig Komponenten ergänzt, die sich ideal für diese Systeme eignen, um mit den Entwicklungen auf diesem Gebiet Schritt zu halten.

 Strahlaufweiter
Strahlaufweiter
- Zur Aufweitung des Anregungsstrahls nach dem Scannerspiegel
- Große Auswahl an Breitband- und Laserlinienbeschichtungen von 257 nm bis 3 µm
- Ausführungen mit Divergenz- und Vergrößerungsanpassung erhältlich
- Baugruppen für hohe Leistungen ohne Geisterbilder durch Fokussierung
JETZT KAUFEN

 Zylinderlinsen für Laseranwendungen
Zylinderlinsen für Laseranwendungen
- Fokussierung des Beleuchtungsstrahls in einer Dimension zur Bildung der Lichtscheibe
- Breitband- und Laserlinienbeschichtungen für gängige Laser
- Laserlinien-Beschichtungen bieten eine Reflexion <0,25%
- Quarzglassubstrat
JETZT KAUFEN

Wasserimmersionsobjektive von Olympus
- Vergrößerungsbereiche von 10 bis 40X
- Zeigen flache Bilder von hohen Transmissionsfaktoren bis in den Nahinfrarotbereich des Spektrums
- Ideal für die Fluoreszenzbildgebung von Gewebe und Proben, wie z. B. Hirngewebe
JETZT KAUFEN

Olympus X-Line erweiterte apochromatische Objektive
- Hohe numerische Aperturen (NA) bis 1,45
- Korrektur der chromatischen Aberration von 400 - 1000 nm
- Gleichmäßige Bildebenheit über große Bildfelder
JETZT KAUFEN

Mitutoyo unendlich korrigierte Objektive mit großem Arbeitsabstand
- Hellfeldinspektion
- Hochqualitatives planapochromatisches Design
- Keine Bildfeldwölbung über das gesamte Bildfeld
JETZT KAUFEN

Spiegelobjektive
- Großer Arbeitsabstand für einfache Systemintegration
- Aktive Ausrichtung für optimale Leistung
- Ultrabreites Spektralband von 190 nm bis 11 μm ohne chromatische Aberration
- Beugungsbegrenzte Optionen mit transmittierter Wellenfront von λ/14 RMS
JETZT KAUFEN

 Fluoreszenz-Bandpassfilter
Fluoreszenz-Bandpassfilter
- Gängige Wellenlängen für häufig verwendete Fluorophore
- Anregungs- und Emissionsfilter erhältlich
- >93% Transmission
- Blockung >OD 6, <3% von der Kante des Durchlassbereichs
- Fluoreszenzfiltersets und vormontierte Fluoreszenzfiltersets im Würfel ebenfalls erhältlich
JETZT KAUFEN

 Dichroitische Fluoreszenzfilter
Dichroitische Fluoreszenzfilter
- Ideal für Fluoreszenzabbildungen und multispektrale Abbildungen
- Scharfer Übergang zwischen Transmission und Reflexion
- Ausgeweitete Transmissions- und Reflexionsbereiche
- Auch hochqualitative dichroitische Fluoreszenzfilter erhältlich
JETZT KAUFEN

 Notchfilter
Notchfilter
- Blocken alle Anregungswellenlängen, die von der Probe streuen könnten
- OD4- und OD6-Optionen
- Große Transmissionsbereiche
JETZT KAUFEN

ScannerMAX Saturn optische Galvanometer-Scanner
- Spiegelaperturen von 3, 5 und 10 mm
- Einachsige oder zweiachsige Aufbauten
- Hochqualitative Scanner für Bildgebung und Projektion
JETZT KAUFEN

Coherent® OBIS™ LX/LS Lasersysteme mit hoher Strahlqualität
- Gleiche kompakte Bauform für alle Wellenlängenbereiche
- Integrierte Steuerelektronik mit Analog- und Digitalmodulation
- Runder Strahl mit bester Strahlqualität
- Coherent® OBIS™ LX/LS fasergekoppelte Lasersysteme mit hoher Strahlqualität ebenfalls verfügbar
JETZT KAUFEN

Optische Schwalbenschwanzschienen
- Große Auswahl an Trägerlängen und Montagebohrloch-Optionen verfügbar
- Flache Bauform mit leichtgängiger Verstellung
- Höhere Stabilität, Abweichung von der geraden Linie <1 mrad
JETZT KAUFEN

Labortische und Lochplatten
- Labortische und Lochplatten
- Option englisch/metrisch
- Umfangreiches Lochplatten-Zubehör und optomechanische Komponenten verfügbar
JETZT KAUFEN
Literatur
- Allen, J. R. “Light Sheet Fluorescence Microscopy.” Nikon, https://www.microscopyu.com/techniques/light-sheet/light-sheet-fluorescence-microscopy
- Pasche-Drews, M. “Application Note: Light Sheet Microscopy.” Teledyne Photometrics, https://www.photometrics.com/applications/appnotes/light-sheet-microscopy.
- Albert-Smet, I. et al. “Applications of Light Sheet Microscopy in Microdevices.” Front. Neuroant. https://www.frontiersin.org/articles/10.3389/fnana.2019.00001/full
- Laissue, P. P., et al. (2017). Assessing phototoxicity in live fluorescence imaging. Nature Methods, 14(7), 657-661. doi: 10.1038/nmeth.4344.
- Olarte, O. E., et al. (2018). Light-sheet microscopy: a tutorial. Advances in Optics and Photonics, 10(1), 111-179. doi.org/10.1364/AOP.10.000111
- Santi, P. A. (2011). Light Sheet Fluorescence Microscopy. J Histochem Cytochem, 59(2), 129-138. doi: 10,1369/0022155410394857
Weitere Informationen
- Brightfield Illumination Microscopy
- Darkfield Illumination Microscopy
- Konfokalmikroskopie
- Differential Interference Contrast Microscopy
- Fluorescence Microscopy
- Multiphotonenmikroskopie
- Phase Contrast Microscopy
- Aufbau von digitalen Videomikroskopen
- Grundlagen zu Mikroskopen und Mikroskopobjektiven
- Überlegungen zur Verwendung von Zylinderlinsen
- What Are Cylinder Lenses?
- Ausbreitung gaußscher Strahlen
- Rechner für Gaußstrahlen
- Laserstrahlaufweiter





































































weitere regionale Telefonnummern
ANGEBOTSTOOL
Geben Sie zum Starten die Produktnummer ein.
Copyright 2023 | Edmund Optics, Ltd Unit 1, Opus Avenue, Nether Poppleton, York, YO26 6BL, UK
Die Edmund Optics GmbH Deutschland fungiert als Handelsvermittler für die Edmund Optics Ltd. in Großbritannien.
Vertragspartner ist die Edmund Optics Ltd. in Großbritannien.